노벨화학상, 분자진화 분야 개척한 3인에게
녹색화학‧약물 개발 성과로 이어져
10월 3일 오후 6시 45분(한국 시간) 노벨화학상 수상자 발표 회견 자리에서 가장 먼저 그리고 자주 들린 단어는 evolution(진화)이었다.
생리의학상이라면 모를까 화학상 발표 현장에서 전혀 예상하지 못한 용어가 나오자 취재진들도 약간 당황한 듯 회견장이 다소 어수선했다.
연구내용을 설명하는 과정에서도 ‘survival of the fittest(적자생존)’, ‘selection(선택)’ 같은 진화 용어가 튀어나왔다.
실제 진화의 주체만 생물체에서 생체분자로 바뀌었을 뿐 핵심 과정은 동일했다. 즉 올해 노벨화학상은 분자진화 분야를 개척한 세 사람에게 주어졌다.

2018년 노벨화학상은 유도진화 방법으로 효소를 개발한 미국 칼텍의 프랜시스 아널드 교수(왼쪽)와 파지디스플레이 방법을 고안한 미국 미주리대 조지 스미스 교수(가운데), 이를 이용해 항체를 만드는 방법을 개발한 영국 MRC분자생물학연구소 그레고리 윈터 박사에게 돌아갔다. ⓒ 노벨위원회
3세대 만에 효소 촉매 효율 수백 배로
먼저 미국 칼텍의 프랜시스 아널드 교수(62)는 효소의 유도진화를 연구한 업적으로 상금의 1/2을 차지하게 됐다.
효소란 단백질 촉매로 세포 안에서 일어나는 화학 반응을 도와주는 일을 한다. 효소의 촉매 작용이 워낙 뛰어나다 보니 상온 상압인 온화한 조건에서도 수많은 화학반응이 일어날 수 있는 것이다.
반면 화학자들이 개발한 화학반응 대다수는 고온 고압 같은 극한 조건과 많은 에너지가 필요하다.
따라서 1980년대에 DNA를 조작할 수 있는 분자생물학 기법이 개발되자 화학자들은 이를 이용해 효소 유전자의 DNA를 바꿔 세포 안과 다른 조건에서도 잘 작동하는 효소를 개발하는 연구에 뛰어들었다.
아널드 역시 이 가운데 한 명이었다.
그러나 효소, 즉 단백질은 아미노산 수백~수천 개로 이뤄진 커다랗고 복잡한 분자라 화학자들이 머리를 굴려 특정 아미노산을 바꿔 자신들이 원하는 방향으로 바뀔 것 같은 변이 효소를 만들어도 예상대로 결과가 나오지 않았다.
이는 한 세대가 지나 컴퓨터가 눈부시게 발달한 오늘날에도 마찬가지다.
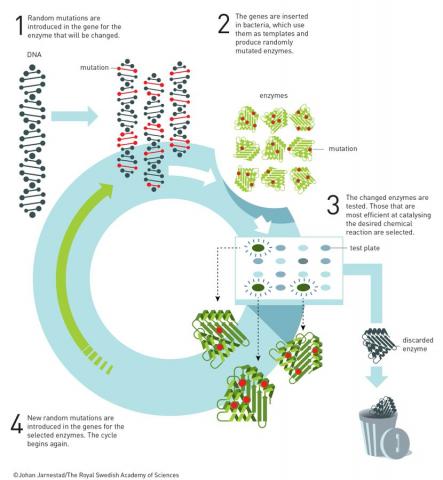
효소의 유도진화 원리를 보여주는 일러스트다. 1. 효소 유전자에 임의의 돌연변이를 일으킨다. 2. 이들 변이 유전자를 박테리아에 넣어 다양한 변이 효소를 얻는다. 3. 변이 효소의 촉매 활성을 측정해 우수한 걸 선택한다. 4. 이 변이 효소의 유전자에 다시 임의의 돌연변이를 일으켜 활성이 더 높은 변이 효소를 선택하는 과정을 반복한다. ⓒ 노벨위원회
1990년대 초 아널드는 화학자들의 ‘오만함’을 인정하고 37억 년 생물의 역사를 이끈 ‘진화’의 원리를 받아들여 화학에 적용하기로 마음을 바꿨다.
즉 효소의 유전자에 임의의 돌연변이를 일으켜 수많은 변이 효소를 얻은 뒤 바라는 조건에서 촉매 활성을 측정해 우수한 변이 효소를 ‘선택’하는 방법을 개발했다.
이렇게 선택된 변이 효소의 유전자를 대상으로 다시 임의의 돌연변이를 일으켜 위의 과정을 반복한다.
그리고 2세대 변이 효소들의 촉매 활성을 측정해 다시 우수한 것들을 선택한다.
필요할 경우 이 과정을 여러 차례 반복해 더 우수한 변이 효소를 얻는다.
이 과정을 ‘유도진화(directied evolution)’라고 부르는데, 목적을 두고 분자 진화를 진행하기 때문이다.
아널드는 서브틸리신(subtilisin)이라는, 우유 단백질 카제인(casein)을 분해하는 효소를 대상으로 이 기법을 처음 적용했다.
즉 자연의 서브틸리신이 작용하는 수용액 조건이 아니라 유기용매에 녹은 상태에서도 촉매 활성을 띠는 변이 서브틸리신을 진화시켰다.
그 결과 유기용매 조건에서 원래 효소보다 256배나 활성이 더 높은 변이 효소를 3세대 만에 만드는 데 성공했다.
화학자들의 머릿속에서 효소를 디자인하는 기존의 방식을 고집했다면 평생을 해도 얻을 수 없는 결과였다.
아널드가 개발한 효소의 유도진화는 그 뒤 특정 조건에서 최고의 성능을 낼 수 있는 다양한 변이 효소의 개발로 이어졌고 오늘날 바이오연료와 플라스틱 등을 만드는데 널리 쓰이고 있다.
그 결과 에너지가 많이 들어가고 유해한 부산물이 나오는 기존 화학반응을 대체하면서 녹색화학(green chemistry) 시대를 여는데 크게 기여하고 있다.
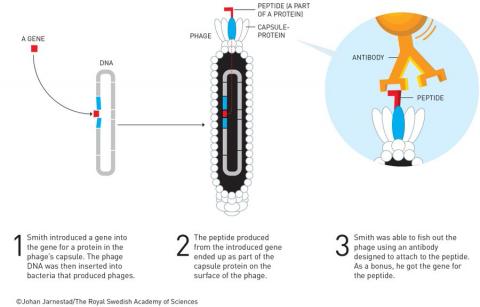
파지디스플레이는 원래 알려진 단백질의 유전자를 찾기 위해 개발된 방법이다. 1. 파지 게놈의 캡슐단백질 유전자에 미지의 유전자를 끼워 넣는다. 2. 끼어 들어간 유전자의 산물인 펩티드가 캡슐단백질의 일부로 파지 표면에 드러난다. 3. 이렇게 만든 수많은 펩티드 가운데 알려진 단백질의 항체에 붙는 펩티드의 유전자가 알려진 단백질의 유전자일 가능성이 높다. ⓒ 노벨위원회
단백질의 유전자 찾는 방법으로 떠올려
다음으로 미국 미주리대 조지 스미스 교수(77)와 영국 MRC분자생물학연구소 그레고리 윈터 박사(67)가 파지디스플레이(phage display)와 여기에 분자진화를 접목해 항체를 만드는 방법을 개발한 공로로 화학상의 나머지 절반을 가져갔다.
파지디스플레이 항체는 오늘날 약물 개발에 널리 쓰이고 있다.
이들의 업적은 기초와 응용으로 나눌 수 있는데 먼저 기초를 연구한 스미스 교수의 업적을 살펴보자.
1980년대 초 아직 유전자를 규명하는 기술이 초보단계일 때 스미스는 박테리오파지를 이용해 이 문제를 해결할 수 있을지 모른다는 아이디어를 떠올렸다.
박테리오파지(bacteriophage. 이하 파지)는 박테리아에 감염하는 바이러스다.
즉 단백질은 알고 있지만 게놈에서 그 단백질의 유전자를 찾기가 매우 어렵던 없던 시절 스미스는 게놈을 임으로 쪼개 그 조각을 파지 게놈(덩치가 작다)의 캡슐단백질 유전자에 끼워 넣으면 그 조각이 지정하는 아미노산들(펩티드)이 파지 표면에 존재할 것이라고 생각했다.
이렇게 만든 수많은 변이 파지를 알고 있는 단백질에 달라붙는, 즉 항원으로 하는 항체와 섞은 뒤 항체와 달라붙는 파지를 선별한다.
그 뒤 파지의 게놈을 분석하면 끼어 들어간 유전자, 즉 단백질의 유전자를 찾을 수 있다.
1985년 스미스는 이 아이디어, 즉 파지디스플레이를 실험실에서 구현하는 데 성공했다.
그러나 그 뒤 PCR(중합체연쇄반응) 등 유전자를 쉽게 찾을 수 있는 방법들이 속속 개발되고 DNA염기서열분석법이 눈부시게 발전하면서 파지디스플레이로 특정 단백질의 유전자를 찾는 방법이 더 이상 필요하지 않게 됐다.
만일 여기서 끝났다면 스미스가 노벨상을 탈 일은 없었을 것이다.
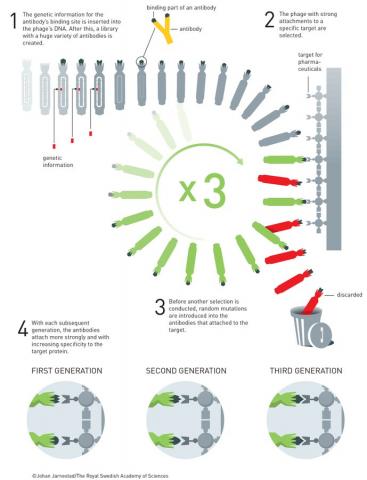
파지디스플레이에 유도진화를 도입해 항체를 개발하는 과정이다. 1. 항체의 결합자리에 해당하는 DNA서열에 다양한 변이를 만든 뒤 파지의 게놈에 집어넣는다. 2. 특정한 표적(항원)에 강하게 달라붙는 파지를 선택한다. 3. 이 항체의 DNA에 다시 임의의 돌연변이를 일으킨다. 4. 세대가 반복될수록 표적단백질에 더 강하고 선별적으로 달라붙는 항체를 얻을 수 있다. ⓒ 노벨위원회
자가면역질환 항체치료제 개발로 이어져
MRC분자생물학연구소 그레고리 윈터 박사는 항체치료제를 개발하고 있었다. 병원체나 암세포, 독소 등을 항원으로 하는 항체를 만들면 효과적인 치료제가 될 수 있기 때문이다.
1980년대 과학자들은 항원을 생쥐의 혈관에 주사해 항체를 만들게 하는 방법을 썼다.
그러나 이렇게 얻은 생쥐의 항체 자체가 인체에서 항원이 된다는 구조적인 문제가 드러났다(외부물질이므로).
이를 고민하던 윈터는 스미스의 파지디스플레이에서 아이디어를 떠올렸다.
즉 사람의 항체 유전자를 파지 게놈에 넣어 표적 항원에 달라붙는 항체를 선별하는 방법이다.
즉 스미스의 파지디스플레이가 파지가 제시한 수많은 펩티드 가운데서 특정 항체에 달라붙는 항원을 찾는 방법이었다면, 윈터의 파지디스플레이는 파지가 제시한 수많은 펩티드 가운데서 특정 항원에 달라 붙는 항체를 찾는 방법이다.
그리고 이 과정에서 앞의 아널드가 개발한 유도진화 기법을 적용했다.
즉 항체 유전자에 임의의 돌연변이를 일으켜 만든 수 많은 변이 항체 가운데 특정 항원에 잘 달라붙는 걸 선별한 뒤 이 유전자에 다시 임의의 돌연변이를 일으켜 더 잘 달라붙는 항체를 추려내는 식이다.
1990년대 윈터는 이 방법으로 여러 자가면역질환에서 염증을 촉발하는 분자인 TNF-알파를 항원으로 하는 항체 아달리무맙(adalimumab)를 개발하는데 성공했고 2002년 류머티스관절염치료제로 미식품의약국(FDA)의 승인을 받았다.
현재 아달리무맙은 건선과 염증성장질환 등 다른 자가면역질환 치료제로도 쓰이고 있다.
오늘날 많은 제약회사들이 파지디스플레이 방법으로 암, 알츠하이머병 등 각종 질환에 대한 항체치료제를 개발하고 있다.
2018년 노벨화학상은 19세기 생물학자 찰스 다윈과 앨프리드 러셀 윌리스가 제안한 진화(evolution) 개념을 150여 년 뒤 분자에 적용해 화학의 혁명(revolution)을 이끈 과학자 세 사람이 차지했다.
- 강석기 과학칼럼니스트
- 저작권자 2018.10.04 ⓒ ScienceTimes